Đề kiểm tra 1 tiết HK2 môn Hóa 10 – THPT Lương Ngọc Quyến 2015
Cập nhật lúc: 16:09 31-03-2016 Mục tin: Đề kiểm tra 45 phút lớp 10
Đề kiểm tra 1 tiết học kì 2 môn Hóa 10 trường THPT Lương Ngọc Quyến 2015 tỉnh Thái Nguyên, các em theo dõi chi tiết bên dưới:
|
SỞ GD&ĐT THÁI NGUYÊN Trường THPT Lương Ngọc Quyến
|
ĐỀ KIỂM TRA 1 TIẾT HỌC KỲ II NĂM HỌC 2014 - 2015 Môn: HÓA HỌC lớp: 10 Thời gian làm bài: 45 phút (Không kể thời gian phát đề) |
Cho: Fe = 56; Al = 27; Mg = 24; Na = 23; Zn = 65; K = 39; Ca = 40; Ag = 108; O = 16; H = 1;
Cl = 35,5; S = 32; Mn = 55
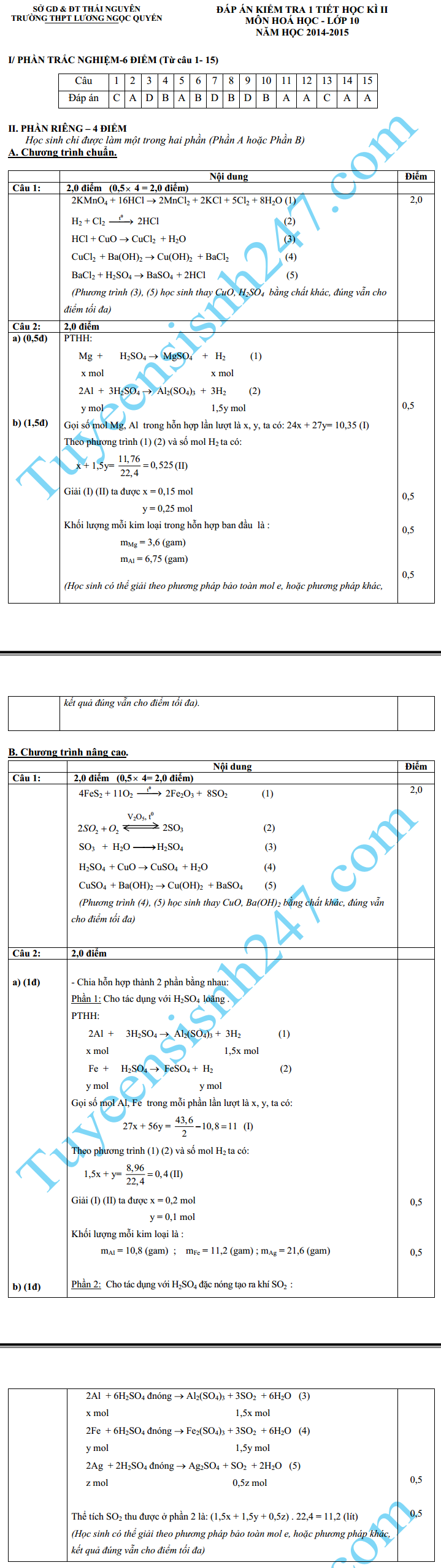
I. PHẦN CHUNG CHO CÁC THÍ SINH (15 câu = 6 điểm).
Câu 1: Cho phương trình phản ứng: S + 2H2SO4 đặc nóng ---> 3SO2 + 2H2O.
Trong phản ứng trên, tỉ lệ giữa số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 3 : 1. B. 1 : 3. C. 2 : 1. D. 1 : 2.
Câu 2: Hoà tan hỗn hợp gồm 0,1 mol Al; 0,3 mol Fe và 0,4 mol Fe3O4 bằng dung dịch HCl dư thu được dung dịch A. Cho A tác dụng với dung dịch NaOH dư, rồi lấy kết tủa nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
A. 120,0. B. 106,8. C. 96,0. D. 130,2.
Câu 3: Tốc độ phản ứng phụ thuộc vào các yếu tố sau :
A. Nhiệt độ. B. Nồng độ, áp suất.
C. Chất xúc tác, diện tích bề mặt. D. cả A, B và C.
Câu 4: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân người ta dùng chất bột rắc lên thủy ngân rồi gom lại. Chất bột đó là:
A. Vôi sống. B. Lưu huỳnh. C. Cát. D. Muối ăn.
Câu 5: Có các dung dịch: NaOH, NaCl, H2SO4, Ba(OH)2. Chỉ dùng thêm một thuốc thử nào sau đây để nhận biết tất cả các dung dịch trên:
A. Quỳ tím. B. BaCl2. C. KOH. D. AgNO3.
Câu 6: Thứ tự tăng dần tính axit của các axit halogen hiđric (HX) là:
A. HCl < HBr < HI < HF. B. HF < HCl < HBr < HI.
C. HBr < HI < HCl < HF. D. HI < HBr < HCl < HF.
Câu 7: Cho phản ứng: H2S + 4Cl2 + 4H2O --> H2SO4 + 8HCl.
Câu phát biểu nào sau đây diễn tả đúng tính chất của các chất phản ứng?
A. Cl2 là chất oxi hóa, H2O là chất khử. B. H2S là chất oxi hóa, Cl2 là chất khử.
C. H2S là chất khử, H2O là chất oxi hóa. D. Cl2 là chất oxi hóa, H2S là chất khử.
Câu 8: Kim loại nào tác dụng với dung dịch HCl loãng và khí Cl2 cho cùng loại muối clorua kim loại ?
A. Cu. B. Zn. C. Ag. D. Fe.
Câu 9: Hấp thụ hoàn toàn 12,8 gam SO2 vào 250 ml dung dịch NaOH 1M thu được dung dịch X chứa:
A. Na2SO3. B. NaHSO3.
C. Na2SO3 và NaOH. D. NaHSO3 và Na2SO3.
Câu 10: Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml dung dịch H2SO4 0,1M (vừa đủ). Sau phản ứng, cô cạn dung dịch thu được muối khan có khối lượng là:
A. 4,81 gam. B. 6,81 gam. C. 3,81 gam. D. 5,81 gam.
Câu 11: Trộn 13 gam một kim loại M hoá trị II (đứng trước hiđro) với lưu huỳnh rồi đun nóng để phản ứng xảy ra hoàn toàn được chất rắn A. Cho A phản ứng với 200 ml dung dịch H2SO4 1,5M (dư) được hỗn hợp khí B nặng 5,2 gam có tỉ khối đối với oxi là 0,8125. Kim loại M là:
A. Zn. B. Ca. C. Mg. D. Fe.
Câu 12: Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 1000 C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất và dung dịch thứ 2 là:
A. 5/3. B. 3/5. C. 3/1. D. 1/3.
Câu 13: Dãy chất nào sau đây gồm những chất đều tác dụng với dung dịch H2SO4 loãng:
A. CuO, Fe(OH)2, Al, Na2SO4. B. Cu, ZnO, NaOH, CaOCl2.
C. Mg, ZnO, Ba(OH)2, CaCO3. D. Na, CaCO3, Mg(OH)2, BaSO4.
Câu 14: Các nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là:
A. ns2np5. B. ns2np6. C. ns2np4. D. ns2np3.
Câu 15: Dung dịch nào trong các dung dịch axit sau đây không được chứa trong bình bằng thủy tinh?
A. HF. B. HCl. C. H2SO4. D. HNO3.
II. PHẦN RIÊNG (4 điểm):Học sinh chỉ được làm một trong hai phần
(Phần A hoặc Phần B)
A. Theo chương trình chuẩn.
Câu 1 (2 điểm): Viết phương trình hóa học của các phản ứng thực hiện các biến đổi dưới đây và ghi rõ điều kiện phản ứng (nếu có):
KMnO4 ---> Cl2HCl --> CuCl2 --> BaCl2 ---> BaSO4.
Câu 2 (2 điểm): Cho 10,35 gam hỗn hợp 2 kim loại là Mg và Al tác dụng với dung dịch H2SO4 loãng, dư. Khi phản ứng kết thúc, thu được 11,76 lít khí (đktc).
a) Viết các phương trình hóa học của các phản ứng đã xảy ra.
b) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
B. Theo chương trình nâng cao.
Câu 1 (2 điểm): Viết phương trình hóa học của các phản ứng thực hiện các biến đổi dưới đây và ghi rõ điều kiện phản ứng (nếu có):
FeS2 --> SO2SO3 --> H2SO4 --> CuSO4 --> BaSO4.
Câu 2 (2 điểm): Chia 43,6 gam hỗn hợp gồm Al, Fe, Ag làm 2 phần bằng nhau:
Phần 1: Tác dụng với dung dịch H2SO4 loãng dư thì được 8,96 lít H2 và 10,8 gam một chất rắn.
Phần 2: Tác dụng với dung dịch H2SO4 đặc, nóng, dư.
- Tính khối lượng mỗi kim loại.
- Tính thể tích SO2 thu được ở phần 2 (các thể tích đo ở đktc).
Đáp án đề kiểm tra 1 tiết HK2 môn Hóa 10 – THPT Lương Ngọc Quyến 2015
Tuyensinh247.com
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 học kì 1 tiết lớp 10 môn Văn 2019 - THPT Chu Văn An(25/09)
- Đề kiểm tra 1 tiết HK2 môn Sử 10 năm 2015 – THPT Trại Cau(19/05)
- Đề kiểm tra 1 tiết HK2 môn Sinh 10 – THPT Lương Đình Của 2016(01/04)
- Đề kiểm tra 1 tiết HK2 2016 môn Anh 10 – THPT An Nhơn 2(01/04)
- Đề kiểm tra 1 tiết HK2 môn Anh 10 – THPT Đoàn Thị Điểm 2016(01/04)
- Đề kiểm tra 1 tiết HK2 Hóa 10 – THPT Nguyễn Văn Linh 2015(29/03)
- Đề kiểm tra 1 tiết HK2 môn Địa 10 – THPT Đốc Binh Kiều 2015(19/03)
- Đề kiểm tra 1 tiết HK2 năm 2015 Sử 10 - THPT Hàn Thuyên (19/03)
- Đề kiểm tra 1 tiết HK2 Sinh 10 – THPT Chế Lan Viên 2015(19/03)
- Đề kiểm tra 1 tiết HK2 Sinh 10 năm 2015 – THPT Lý Bôn(19/03)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi kì 2 lớp 12 môn Văn 2024 -...
- Đề thi kì 2 lớp 9 môn Văn 2024 -...
- Đề thi kì 2 môn Văn lớp 9 năm 2024...
- Đề thi kì 2 lớp 5 môn Khoa học 2023...
- Đề thi kì 2 lớp 5 môn Anh năm 2023...
- Đề thi kì 2 môn Sử Địa lớp 5 năm...
- Đề thi kì 2 lớp 5 môn Tiếng Việt 2023...
- Đề thi kì 2 môn Toán lớp 5 năm 2023...
- Đề thi cuối kì 2 môn GDCD lớp 6 -...
- Đề thi học kì 2 lớp 6 môn KHTN 2023...
Cập nhật đề thi học kì của các trường trên cả nước tất cả các năm